Синтез гемоглобина в организме
Биосинтез гемоглобина
Учитывая, что белковая часть молекулы гемоглобина (глобин) синтезируется, как и все остальные белки, далее подробно рассмотрен биосинтез его простетической группы, т.е. синтез тетрапиррольного соединения – гема (см. главу 2).
К настоящему времени почти полностью выяснены основные пути образования порфиринов и протопорфиринов, являющихся непосредственными предшественниками гема и хлорофилла. Благодаря исследованиям Д. Шемина и др. выяснены основные пути синтеза гема. С помощью меченых предшественников было показано, что в синтезе гема в бесклеточных экстрактах эритроцитов птиц специфическое участие принимают глицин, уксусная и янтарная кислоты. Источником всех 4 атомов азота и 8 атомов углерода тетрапиррольного кольца оказался глицин, а источником остальных 26 из 34 атомов углерода – янтарная кислота (сук-цинат), точнее ее производное сукцинил-КоА. Последовательность химических реакций синтеза тетрапирролов в организме животных можно условно разделить на несколько стадий.
На I стадии, протекающей в 2 этапа, сукцинил-КоА взаимодействует с глицином и образованием δ-аминолевулиновой кислоты (δ-АЛК).
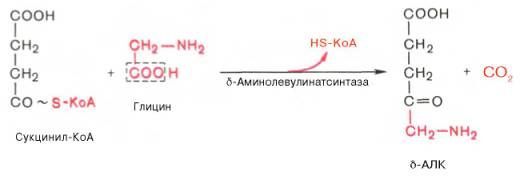
Эту стадию катализирует специфический пиридоксальфосфатзависимый фермент δ-аминолевулинатсинтаза – ключевой, аллостерический фермент синтеза тетрапирролов.
Впервые эта синтаза была обнаружена в эндоплазматической сети клеток печени. Фермент индуцируется стероидами и другими факторами и ингибируется по типу обратной связи конечным продуктом биосинтеза – гемом.
На II стадии происходит конденсация 2 молекул δ-аминолевулиновой кислоты с образованием первого монопиррольного соединения – порфо-билиногена (ПБГ).
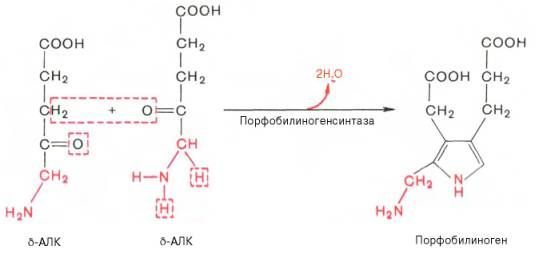
Фермент, катализирующий эту стадию,– порфобилиногенсинтаза также является регуляторным ферментом, подвергаясь ингибированию конечными продуктами синтеза. Предполагают, что механизм этой сложной реакции дегидратации включает образование кетиминной связи (шиффово основание) между кетогруппой одной молекулы δ-аминолевулиновой кислоты и δ-аминогруппой лизина молекулы фермента. В следующей многоступенчатой стадии, катализируемой соответствующими ферментами, из 4 монопиррольных молекул порфобилиногена синтезируется тетра-пиррольный комплекс протопорфирин IX, являющийся непосредственным предшественником гема. Некоторые этапы сложного пути синтеза окончательно не установлены.
В заключительной стадии протопорфирин IX присоединяет молекулу железа при участии феррохелатазы (гемсинтазы), и образуется гем. Последний используется для биосинтеза всех гемсодержащих хромопро-теинов.
Источником железа для этой реакции является ферритин, который считается резервным гемопротеином, откладывающимся в клетках костного мозга, печени и селезенки.
Имеются указания, что, помимо железа, в синтезе гема участвуют некоторые кофакторы, в частности витамин В12, ионы меди, хотя конкретная их роль не раскрыта.
Таким образом, весь путь синтеза гема может быть представлен в виде схемы, в которой даны полные и сокращенные обозначения промежуточных метаболитов и ферментов.
Обмен и распад гемоглобина в организме
Hb содержится в эритроцитах, составляя 95% от их сухой массы. Эритроциты живут 100-120 дней. Ежедневно образуется 250 млрд эритроцитов. Синтез гемоглобина происходит в кроветворных органах, причем гем и глобин синтезируются по отдельности. Затем соединяются, и образуется третичная и четвертичная структура гемоглобина.
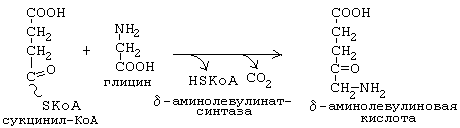
дельта-аминолевулинатсинтаза является ключевым ферментом биосинтеза гема. Коферментом дельта-аминолевулинатсинтазы является пиридоксаль-фосфат (производное витамина В6). Фермент ингибируется по принципу отрицательной обратной связи избытком гема.
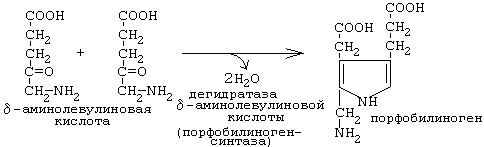
Порфобилиногенсинтаза тоже угнетается избытком гема.
Необходимо знать схему дальнейших реакций, протекающих при синтезе гема:
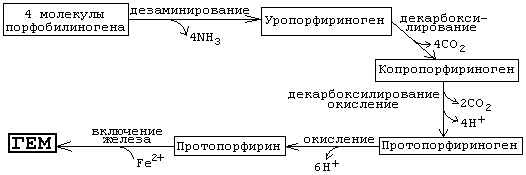
Источник железа — белок ферритин. В комплексе с ферритином в организме хранится (депонируется) резерв железа. Известны генетические дефекты ферментов, участвующих в синтезе гема. При этом происходит накопление в организме предшественников протопорфирина.
Эти болезни называются «порфирии». Есть порфирии, при которых накапливается уропорфириноген. Моча у таких больных имеет красный цвет, а зубы при ультрафиолетовом облучении сильно флуоресцируют, кожа — имеет повышенную чувствительность к солнечному свету. При некоторых порфириях происходит накопление порфобилиногена, что сопровождается нервно-психическими расстройствами.
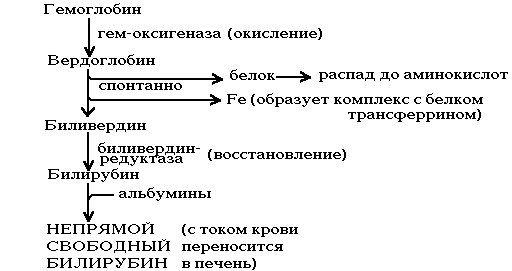 |
Происходит в мононуклеарных фагоцитах (в селезенке и печени). Сначала происходит разрыв связи между I-м и II-м кольцами. Фермент — НАДзависимая оксигеназа. После ее действия образуется пигмент зеленого цвета — вердоглобин. В его составе сохраняется и железо и белок. В дальнейшем вердоглобин распадается на составные части: белок, железо и пигмент-биливердин. Железо образует комплекс с белком трансферрином, и этот комплекс поступает в ткани, где оно снова может быть использовано для синтезов или депонироваться в виде комплекса с белком ферритином.
Билирубин плохо растворим в воде, поэтому он адсорбируется на альбумине крови. Такой комплекс называется СВОБОДНЫМ или НЕПРЯМЫМ БИЛИРУБИНОМ. Он свободный, потому что не связан ни с каким другим веществом ковалентными связями; непрямой, потому что не дает прямой реакции с диазореактивом Эрлиха (для определения этого вида билирубина необходимо предварительно осадить альбумины).
В печени непрямой билирубин подвергается обезвреживанию путем связывания с глюкуроновой кислотой. В реакции расходуется УТФ. При этом к молекуле билирубина присоединяются 2 молекулы глюкуроновой кислоты (образование билирубиндиглюкуронида). Это вещество малотоксично и хорошо растворяется в воде, называется ПРЯМЫМ СВЯЗАННЫМ БИЛИРУБИНОМ, т.к. определяется в прямой реакции с диазореактивом Эрлиха и связан ковалентно с глюкуроновой кислотой. В таком виде билирубин поступает в желчь и вместе с ней выводится из организма.
При определении содержания билирубина используют диазореактив Эрлиха, который дает розовую окраску с билирубином и по ее интенсивности судят о концентрации билирубина в крови.
В крови человека примерно 75% непрямого билирубина от его общего количества. Общее содержание билирубина в норме (прямой+непрямой) от 8 до 20 мкмоль/л.
Билирубин — это конечный продукт распада гемоглобина у человека. Однако, поступив с желчью в кишечник, он превращается под действием ферментов микрофлоры кишечника. Сначала от него отщепляется глюкуроновая кислота, затем происходит частичное восстановление и образуется вещество, называемое «мезобилиноген «, а затем стеркобилиноген. Стеркобилиноген в основном выводится с калом и на воздухе (в кале) превращается в стеркобилин, а мезобилиноген частично всасывается из кишечника по системе v.portae, т.е. попадает в печень и там разрушается. Поэтому его нет у здоровых людей в крови. Небольшая часть стеркобилиногена тоже всасывается из кишечника через систему геморроидальных вен, т.е. попадает сразу в большой круг кровообращения, минуя печень, поэтому часть его выводится с мочой.
Значит, стеркобилиноген является компонентом мочи в норме.
Билирубин (в основном непрямой) — в норме (8-17мкмоль/л)
Гемоглобин — в норме (мужчины — 130-145 г/л; женщины — 110-130 г/л
Моча: светло-желтого цвета, стеркобилиноген — в норме, мезобилиногена нет.
Кал: нормальной окраски, стеркобилиноген — в норме
При некоторых заболеваниях билирубин начинает накапливаться в слизистых оболочках, коже, склерах. Человек «желтеет». Этот симптом называется ЖЕЛТУХА и наблюдается при желчнокаменной болезни, гемолизе, инфекционном или токсическом гепатитах. Определение билирубина в моче, в крови и в кале позволяет выявить причины желтухи.
ГЕМОЛИТИЧЕСКАЯ ЖЕЛТУХА Наблюдается при усилении распада эритроцитов. Билирубина образуется больше, чем в норме и скорость экскреции тоже увеличивается. Непрямой билирубин повышается в крови. В моче билирубина нет, а содержание стеркобилина в кале и в моче повышено.
ОБТУРАЦИОННАЯ ЖЕЛТУХА (механическая) Наблюдается при закупорке желчных протоков (например, при желчнокаменной болезни). Желчь продолжает вырабатываться, но поступает не только в желчные протоки, а также в кровь. В крови повышается уровень билирубина, в основном — прямого билирубина. Наблюдается билирубинурия. Содержание стеркобилина в моче и в кале снижено (кал становится светлым, а моча темнеет за счет прямого билирубина).
ПЕЧЕНОЧНОКЛЕТОЧНАЯ ЖЕЛТУХА (паренхиматозная). Наблюдается при повреждении гепатоцитов (например, при вирусном гепатите). Билирубин не обезвреживается. Желчные пигменты поступают не только в кишечник, но и в кровь. Т.е. в крови повышается содержание не только прямого, но и непрямого билирубина. Наблюдается билирубинурия. В моче обнаруживают мезобилиноген.
Синтез гемоглобина
Почти на 85% биосинтез гема происходит в костном мозге и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма. Гем и глобин синтезируются по отдельности. Затем соединяются, и образуется третичная и четвертичная структура гемоглобина.
Синтез тетрагидропиррольных колец начинается в митохондриях (рис.11,12). Из сукцинил-КоА конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5-аминолевулинат-синтаза (ALA-синтаза) является ключевым ферментом всего пути. Коферментом дельта-аминолевулинатсинтазы является пиридоксаль-фосфат (производное витамина В6). Фермент ингибируется по принципу отрицательной обратной связи избытком гема.
После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген (рис.12,13), который уже содержит пиррольное кольцо . Порфобилиногенсинтаза ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината.
Порфобилиногенсинтаза тоже угнетается избытком гема.
На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованием уропорфириногена III катализируется гидроксиметилбилан-синтазой . Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза . Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I.
Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп (5). Образующийся копропорфириноген III снова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две
пропионатные группы (R2) превращаются в винильные (6). Модификация боковых цепей заканчивается образованием протопорфириногена IX.
На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов (7). В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа (8). Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин, где он связан нековалентно, или в цитохром С, с которым связывается ковалентно.
Суммарно этот процесс представлен на рисунке 14.
Источник железа — белок ферритин. В комплексе с ферритином в организме хранится (депонируется) резерв железа.
В статье использованы материалы:
http://biofile.ru/bio/10602.html



