Соединения гемоглобина в крови
Глава 6. СИСТЕМА КРОВИ
Гемоглобин и его соединения
Основные функции эритроцитов обусловлены наличием в их составе особого белка хромопротеида — гемоглобина. Молекулярная масса гемоглобина человека равна 68 800. Гемоглобин состоит из белковой (глобин) и железосодержащей (гем) частей. На 1 молекулу глобина приходится 4 молекулы гема.
В крови здорового человека содержание гемоглобина составляет 120—165 г/л (120—150 г/л для женщин и 130—160 г/л для мужчин). У беременных содержание гемоглобина может понижаться до 110 г/л, что не является патологией.
Основное назначение гемоглобина — транспорт О2 и СО2. Кроме того, гемоглобин обладает буферными свойствами, а также способностью связывать некоторые токсичные вещества.
Гемоглобин человека и различных животных имеет разное строение. Это касается белковой части — глобина, так как гем у всех представителей животного мира имеет одну и ту же структуру. Гем состоит из молекулы порфирина, в центре которой расположен ион Fe2+, способный присоединять О2. Структура белковой части гемоглобина человека неоднородна, благодаря чему белковая часть разделяется на ряд фракций. Большая часть гемоглобина взрослого человека (95—98%) состоит из фракции А (от лат. adultus — взрослый); от 2 до 3% всего гемоглобина приходится на фракцию А2; наконец, в эритроцитах взрослого человека находится так называемый фетальный гемоглобин (от лат. fetus — плод), или гемоглобин F, содержание которого в норме подвержено значительным колебаниям, хотя редко превышает 1—2%. Гемоглобины А и А2 обнаруживаются практически во всех эритроцитах, тогда как гемоглобин F присутствует в них не всегда.
Гемоглобин F содержится преимущественно у плода. К моменту рождения ребенка на его долю приходится 70—95%. Гемоглобин F имеет большее сродство к О2, чем гемоглобин А, что позволяет тканям плода не испытывать гипоксии, несмотря на относительно низкое напряжение О2 в его крови. Эта приспособительная реакция объясняется тем, что гемоглобин F труднее вступает в связь с 2,3-дифосфоглицернновой кислотой, которая уменьшает способность гемоглобина переходить в оксигемоглобин, а следовательно, и обеспечивать легкую отдачу О2 тканям.
Гемоглобин обладает способностью образовывать соединения с О2, СО2 и СО. Гемоглобин, присоединивший О2, носит наименование оксигемоглобина (ННbО2); гемоглобин, отдавший О2, называется восстановленным, или редуцированным (ННb). В артериальной крови преобладает содержание оксигемоглобина, от чего ее цвет приобретает алую окраску. В венозной крови до 35% всего гемоглобина приходится на ННb. Кроме того, часть гемоглобина через аминную группу связывается с СО2, образуя карбогемоглобин (ННbСО2), благодаря чему переносится от 10 до 20% всего транспортируемого кровью СО2.
Гемоглобин способен образовывать довольно прочную связь с СО. Это соединение называется карбоксигемоглобином (ННЬСО). Сродство гемоглобина к СО значительно выше, чем к О2, поэтому гемоглобин, присоединивший СО, неспособен связываться с О2. Однако при вдыхании чистого О2 резко возрастает скорость распада карбоксигемоглобина, чем пользуются на практике для лечения отравлений СО.
Сильные окислители (ферроцианид, бертолетова соль, пероксид, или перекись, водорода и др.) изменяют заряд от Fe2+ до Fe3+, в результате чего возникает окисленный гемоглобин — прочное соединение гемоглобина с О2, носящее наименование метгемоглобина. При этом нарушается транспорт О2, что приводит к тяжелейшим последствиям для человека и даже смерти.
Цветовой показатель
О содержании в эритроцитах гемоглобина судят по так называемому цветовому показателю, или фарб-индексу (Fi, от farb — цвет, index — показатель) — относительной величине, характеризующей насыщение в среднем одного эритроцита гемоглобином. Fi — процентное соотношение гемоглобина и эритроцитов, при этом за 100% (или единиц) гемоглобина условно принимают величину, равную 166,7 г/л, а за 100% эритроцитов — 5*10 /л. Если у человека содержание гемоглобина и эритроцитов равно 100%, то цветовой показатель равен 1. В норме Fi колеблется в пределах 0,75—1,0 и очень редко может достигать 1,1. В этом случае эритроциты называются нормохромными. Если Fi менее 0,7, то такие эритроциты недонасыщены гемоглобином и называются гипохромными. При Fi более 1,1 эритроциты именуются гиперхромными. В этом случае» объем эритроцита значительно увеличивается, что позволяет ему содержать большую концентрацию гемоглобина. В результате создается ложное впечатление, будто эритроциты перенасыщены гемоглобином. Гипо- и гиперхромия встречаются лишь при анемиях. Определение цветового показателя важно для клинической практики, так как позволяет провести дифференциальный диагноз при анемиях различной этиологии.
Что такое карбогемоглобин и какая его норма должна быть в крови
Дыхание — непременное условие жизнедеятельности клеток организма, которые поглощают кислород и выделяют двуокись углерода. Функцию транспортного средства, доставляющего О2 и выводящего СО2, выполняет кровь. Карбогемоглобин — это ее важная составляющая, участвующая в газообмене.
Что это такое
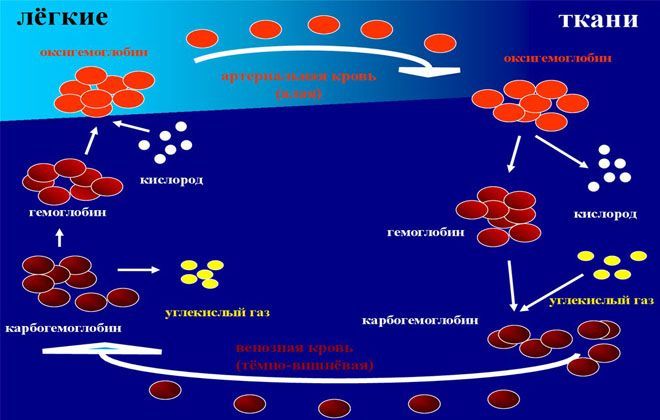
Гемоглобин (Hb) состоит из гема, соединения, содержащего железо, и белкового вещества глобина. Связываясь с О2, поступающим в кровь из легких, Hb снабжает им ткани, а соединяясь с СО2, очищает их от двуокиси углерода и доставляет ее к альвеолам, через которые этот газ удаляется в атмосферу.
Существуют 3 фракции (вида, модификации) гемоглобина, обусловленные физиологическими функциями. Соединяясь с О2, Hb превращается в оксигемоглобин НbО2. Это ярко-красное вещество преобладает в артериальной крови. Кроме того, оно содержится и в миокарде, во всех скелетных мышцах. Мышечный гемоглобин связывает около 10-14% всего О2 в организме. Миоглобин обеспечивает мышцы кислородом, когда они сокращаются, поскольку в это время кровоток приостанавливается.
НbО2, отдав тканям кислород, преобразуется в восстановленный (редуцированный) гемоглобин HНb. Эта субстанция содержится в венозной крови, обуславливая ее темно-вишневую окраску.
Соединение гемоглобина с углекислым газом называется карбогемоглобином. НbСO2 выводит двуокись углерода из клеток и транспортирует в легкие до 20% этого газа. Карбогемоглобин тоже содержится в венозной крови. Hb непрерывно преобразуется из оксигемоглобина в карбогемоглобин и обратно.
Кроме того, Hb образует стойкое соединение с глюкозой, содержащейся в крови. При диабете уровень гликированного гемоглобина HbA1c существенно возрастает. По динамике его концентрации можно судить об эффективности лечения этого заболевания.
Еще одна модификация Hb — фетальный гемоглобин, который содержится в крови новорожденных и исчезает к 1 году. Его наличие у взрослых свидетельствует о нарушениях в организме.
Однако Hb может видоизменяться, образуя и патологические модификации. Соединение гемоглобина с угарным газом называется карбоксигемоглобином. HbСО утрачивает способность транспортировать О2, поэтому клетки испытывают острое кислородное голодание. Анализ на наличие карбоксигемоглобина используется в криминалистике, поскольку позволяет выявить скрытые следы крови. Так, например, отсутствие HbСО в костной ткани трупного материала доказывает, что погибший был уже мертв до начала пожара.
От сильной гипоксии ткани также страдают, когда Hb окисляется и двухвалентное железо в геме замещается трехвалентным Fe. Образующийся при этом метгемоглобин HbMet настолько прочно связывается с О2, что практически не отдает его клеткам. Такое патологическое состояние наступает при отравлении нитратами, нитритами, анилинами, перекисью водорода, марганцовокислым калием, бертолетовой солью и другими веществами-окислителями.
Норма и отклонения
Количество гемоглобина в крови считается оптимальным в следующих пределах (г/л):
- у мужчин: 130-160, после 55-60 лет — 120-140;
- у женщин: 120-140, при беременности — 110-150;
- у детей: до 6 лет — 110-140, до 15 лет — 115-150;
- у жителей высокогорных районов: на 10-20 г/л выше.
Карбоксигемоглобин обнаруживается у некурящих в диапазоне от 0,5 до 1,5%, а у курильщиков — от 4 до 9% от всего объема Hb. О тяжелых отравлениях свидетельствуют показатели более 20%.
Норма в крови метгемоглобина — 0,04-1,52 %. При отравлениях концентрация HbMet достигает более 15%. Летальный исход наступает, если отклонения в показателях превышают 70%.
Проведение и расшифровка анализа
Результаты исследования Hb в медучреждениях нередко отличаются друг от друга, поскольку лаборатории оснащены приборами разных поколений. При проведении анализов крови нередко сказывается и субъективный фактор, зависящий от квалификации лаборанта. Кроме того, следует иметь в виду, что количество гемоглобина максимально вечером и минимально утром.
Сегодня наиболее распространен традиционный метод Сали. Содержание Hb определяют, добавляя к крови соляную кислоту. При этом гем, соединяясь с HCl, преобразуется в кристаллический гемин. Анализы биоматериалов на гемин применяются в судебной медицине для выявления следов крови.
Наиболее точные результаты дает автоматизированный метод с использованием гемометра. Такое исследование проводится гораздо быстрее. Но и при этом методе возможны незначительные расхождения показателей. Однако при расшифровке анализа следует обращать внимание на большие отклонения от нормы Hb, которые свидетельствуют о патологических процессах.
Так, избыток гемоглобина может быть следствием:
- легочной недостаточности;
- обезвоживания организма;
- химических отравлений;
- заболеваний крови, печени, кишечника;
- пороков сердца и др.
Дефицит Hb может быть признаком:
- анемий различной этиологии;
- нарушений менструального цикла;
- эрозий и изъязвлений ЖКТ;
- внутренних кровотечений;
- инфекций;
- воспалительных процессов с отечностью;
- сахарного диабета;
- заболеваний почек;
- злокачественных опухолей и других патологий.
При существенных отклонениях гемоглобина от нормы следует незамедлительно пройти углубленное обследование организма. Вовремя назначенное лечение позволит избежать развития многих опасных заболеваний.
Лазер Вирта
Энциклопедия экономики
Соединение гемоглобина с углекислым газом называется
Гемоглобин и его соединения
Гемоглобин (Нв) – основной компонент эритроцитов, благодаря которому эритроциты выполняют дыхательную функцию и поддерживают рН крови. По химической природе он относится к хромопротеидам. У мужчин в крови содержится в среднем 130-160 г/л гемоглобина, у женщин – 120‑150 г/л. Молекулярная масса гемоглобина составляет около 60000 Да. Гемоглобин состоит из белка глобина и 4 молекул гема. Гем имеет в своем составе атом железа, способный присоединять или отдавать молекулу кислорода. Гем содержит двухвалентное железо, которое играет ключевую роль в деятельности гемоглобина, являясь его активной (простетической) группой. Гемоглобин синтезируется эритро- и нормобластами костного мозга. Для нормального синтеза гемоглобина необходимо достаточное поступление железа с пищей. При разрушении эритроцитов гемоглобин, после отщепления гема, превращается в билирубин — желчный пигмент, который поступает, в основном, в кишечник в составе желчи, где превращается в стеркобилин, выводящийся из организма с каловыми массами. Часть билирубина удаляется с мочой в виде уробилина.
Основная функция гемоглобина — перенос кислорода и углекислого газа. Гемоглобин, присоединивший к себе кислород, превращается в оксигемоглобин. Соединение гемоглобина с кислородом происходит в капиллярах легких. Это соединение непрочное. В виде оксигемоглобина переносится большая часть кислорода. Гемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. Гемоглобин, соединенный с углекислым газом носит название карбгемоглобина. Соединение гемоглобина с углекислым газом происходит в капиллярах тканей организма. Это соединение легко распадается. В виде этого соединения переносится 20 % СО2. Оксигемоглобин и карбгемоглобин являются физиологическими соединениями гемоглобина.
В скелетных и сердечной мышцах находится мышечный гемоглобин, называемый миоглобином. Он играет важную роль в снабжении кислородом работающих мышц, его можно рассматривать, как депо О2 в мышцах.
Имеется несколько форм гемоглобина, отличающихся строением белковой части – глобина. Первые 7-12 нед. внутриутробного развития зародыша его красные кровяные тельца содержат примитивный гемоглобин. У плода содержится гемоглобин F (80 %) или фетальный гемоглобин (от англ. Faetus – плод) гемоглобин. Он обладает более высокой способностью связывать кислород. Это помогает плоду не испытывать гипоксии при относительно низком парциальном напряжении кислорода в его крови. После рождения гемоглобин F практически полностью заменяется на взрослый – гемоглобин А (от англ. adult – взрослый). В эритроцитах взрослого человека содержатся гемоглобин А (95‑98 % Hb A1 и 2-3 % HbA2 ).
Гемоглобин может вступать в соединение и с другими газами. Соединение гемоглобина с угарным газом (СО) называется карбоксигемоглобином — это патологическое соединение, в норме его не существует, т.к. в атмосфере отсутствует СО. Является прочным соединением. Гемоглобин блокирован в нем угарным газом и не способен осуществлять перенос кислорода. Сродство гемоглобина к угарному газу выше его сродства к кислороду, поэтому даже небольшое количество угарного газа в воздухе является опасным для жизни. При этом более критическим является не концентрация угарного газа, а длительность его вдыхания. Даже предельно низкое содержание СО в воздухе, но при длительном вдыхании, например, во время сна может оказаться летальным. Вследствие своего высокого сродства угарный газ в виде карбоксигемоглобина способен циркулировать в крови предельно долго.
Часто отравления угарным газом возникают у водителей при длительном нахождении в закрытом гараже с включенным двигателем автомобиля. Другим распространенным клинически значимым источником СО являются древесный дым, а также сырой кирпич печей изб и свежий печной лак. Поэтому при первом или после длительного перерыва протапливании таких печей необходимо тщательное проветривание помещения.
Особенностью угарного газа является то, что он не обладает запахом, поэтому отравление развивается незаметно. Часто пострадавший осознает это, когда проявляется миорелаксирующее (расслабление скелетной мускулатуры) действие угарного газа, при этом человек не может самостоятельно покинуть помещение.
Первая помощь при отравлении угарным газом. Пострадавшего следует переместить на свежий воздух. Следует учитывать, что при значительном отравлении сохранность самостоятельного дыхания не снимает необходимости проведения дальнейших действий по оказанию помощи. Наиболее оптимальным будет подача воздуха с повышенным содержание О2, например, из кислородной подушки. При отсутствии таковой – произвести искусственное дыхание. Во время искусственного дыхания в легкие потерпевшего воздух нагнетается под давлением, большим атмосферного. При этом парциальное давление О2 в таком воздухе оказывается большим, чем в норме, что способствует его большему растворению в крови, а также лучшему вытеснению угарного газа из связи с гемоглобином. Если же пострадавший будет дышать самостоятельно, парциальное давление О2 во вдыхаемом воздухе окажется меньшим (примерно, 100 мм рт.ст.), что окажется недостаточным для вытеснения из карбоксигемоглобина угарного газа, т. к. сродство Нb к СО значительно выше, чем О2. В дальнейшем пострадавший должен быть доставлен в больницу.
При воздействии на гемоглобин экзогенных сильных окислителей происходит окисление железа гема с переходом его в 3-х валентную форму. В результате этого образуется метгемоглобин, который не способен присоединять ни О2, ни СО2. В результате окисления гемоглобин прочно удерживает кислород и теряет способность отдавать его тканям, что может привести к гибели организма. К подобным сильным окислителем относятся нитраты и нитриты, содержащиеся, например, в химических удобрениях, также опасность представляют пероксиды, нитрокраски, анилиновые красители и ряд других веществ бытовой химии. В норме ежедневно около 0,5 % всего гемоглобина превращается в метгемоглобин, но затем она снова восстанавливается в гемоглобин специальным ферментом метгемоглобинредуктазой. Встречаются наследственные метгемоглобинемии, когда снижена активность метгемоглобинредуктазы в эритроцитах, что вызывает кислородное голодание.
Метгемоглобин, также как карбоксигемоглобин, относится к группе патологических соединений гемоглобина.
Дата добавления: 2015-06-10; просмотров: 2170;
В статье использованы материалы:
http://krov.expert/analiz/karbogemoglobin.html
http://myholesterin.ru/narodnye-sredstva/kurkuma-ot-holesterina-recept.html


